新SOTA,浙大、中科院深度學習模型可靠、準確預測蛋白-配體,助力藥物開發

編輯 | 蘿卜皮
準確預測蛋白質-配體相互作用對于理解細胞過程至關重要,目前仍面臨著諸多挑戰。
中國科學院、浙江大學的研究人員提出了 SurfDock,這是一種深度學習方法,通過將蛋白質序列、三維結構圖和表面級特征整合到等變架構中來解決這一挑戰。
SurfDock 在非歐幾里德流形上采用生成擴散模型,優化分子平移、旋轉和扭轉以生成可靠的結合姿勢。
在各種基準評估中,SurfDock 在對接成功率和遵守物理約束方面均優于現有方法。它還表現出對未見蛋白質和預測的載脂蛋白結構的顯著通用性,同時在虛擬篩選任務中實現了最先進的性能。
在實際應用中,SurfDock 在針對細胞代謝中的關鍵酶醛脫氫酶 1B1 的虛擬篩選項目中確定了七種新的命中分子。
SurfDock 具有闡明細胞過程背后的分子機制的能力,可以為理解蛋白質-配體相互作用提供更高的準確性、物理合理性和實際適用性。
該研究以「SurfDock is a surface-informed diffusion generative model for reliable and accurate protein–ligand complex prediction」為題,于 2024 年 11 月 27 日發布在《Nature Methods》。

了解蛋白質-配體相互作用是分子生物學和生物化學的基礎。這些相互作用是許多細胞過程的核心,從酶催化到信號轉導。它們在維持細胞穩態、調節基因表達和協調復雜的生物途徑方面發揮著至關重要的作用。
通過闡明這些相互作用,科學家可以深入了解疾病的機制、細胞功能和進化過程。蛋白質-配體相互作用的基礎知識為基于結構的藥物設計 (SBDD) 鋪平了道路。
SBDD 利用研究者對這些相互作用的理解來發現或設計與特定蛋白質結合的配體,從而調節其功能從而達到治療目的。藥物的有效性在很大程度上取決于它與目標蛋白質的結合程度以及它是否會影響體內的其他蛋白質。
分子對接方法是應對蛋白質-配體相互作用的一種重要方法,但是目前傳統和基于深度學習的配體對接方法都面臨對接精度或姿勢合理性的限制。
新方法 SurfDock
在最新的研究中,為了解決這些限制,中國科學院、浙江大學的研究團隊提出了 SurfDock,這是一種幾何擴散網絡,旨在生成可靠且準確的結合配體姿勢。
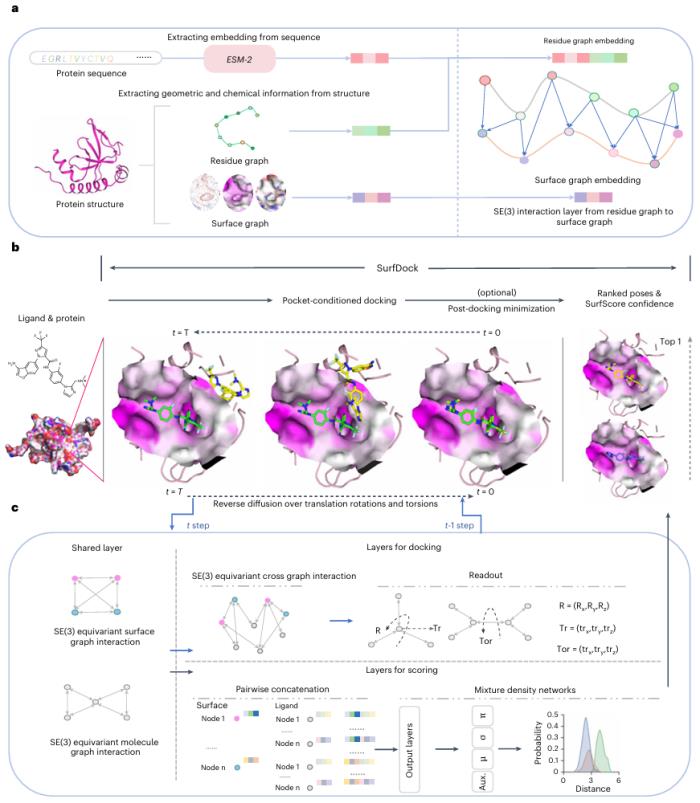
SurfDock 的擴散過程取決于蛋白質口袋和隨機起始配體構象。它還包括一個內部評分模塊 SurfScore,該模塊在晶體蛋白質-配體復合物上進行訓練,用來評估姿勢的置信度。
SurfDock 將多模態蛋白質信息(如表面特征、殘基結構特征和預訓練的序列級特征)整合到表面節點級表示中。因此,它在多個基準測試中的對接成功率均達到最高水平。這些基準測試包括 PDBbind2020、Astex Diverse Set、PoseBusters 基準測試集和 DockGen 數據集。
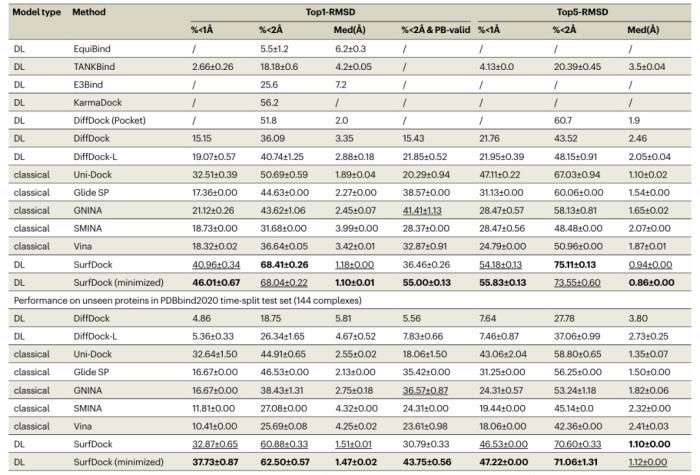
圖示:PDBbind2020 數據集對接性能的比較分析。(來源:論文)
在生成的姿勢的合理性方面,SurfDock 明顯優于以前的 DL 方法。SurfDock 還結合了可選的基于力場的簡單松弛步驟,用于蛋白質固定配體優化,從而進一步提高了其準確性和有效性。
此外,SurfDock 可有效推廣到新的蛋白質或口袋,并且對不同的配體靈活性具有很強的適應性。研究人員在虛擬篩選基準數據集 DEKOIS 2.0 上對 SurfDock 進行了概念驗證評估。結果顯示,SurfDock 不僅與現有對接方法的性能相當,而且超過了它們的性能。
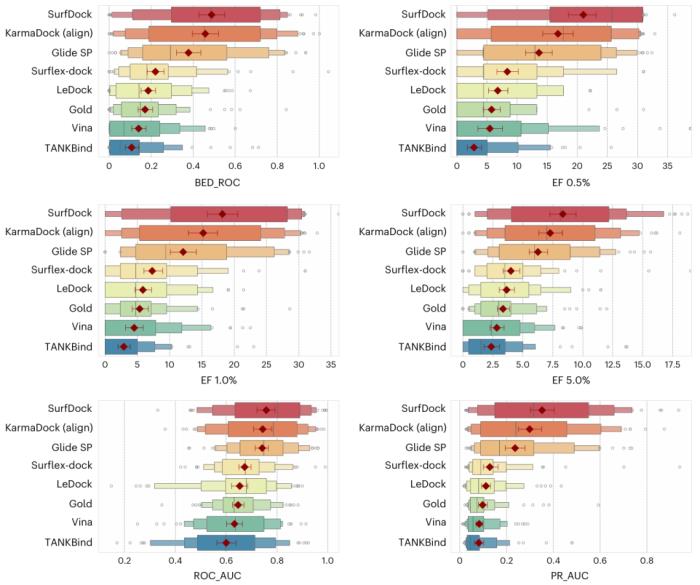
圖示:不同對接方法在 DEKOIS 2.0 數據集上的表現。(來源:論文)
考慮到近年來蛋白質結構預測技術的進步,該團隊還測試了 SurfDock 在計算預測的 apo 結構上的性能。借助表面表示帶來的隱式靈活性,SurfDock 在 apo 結構上也取得了顯著的性能。
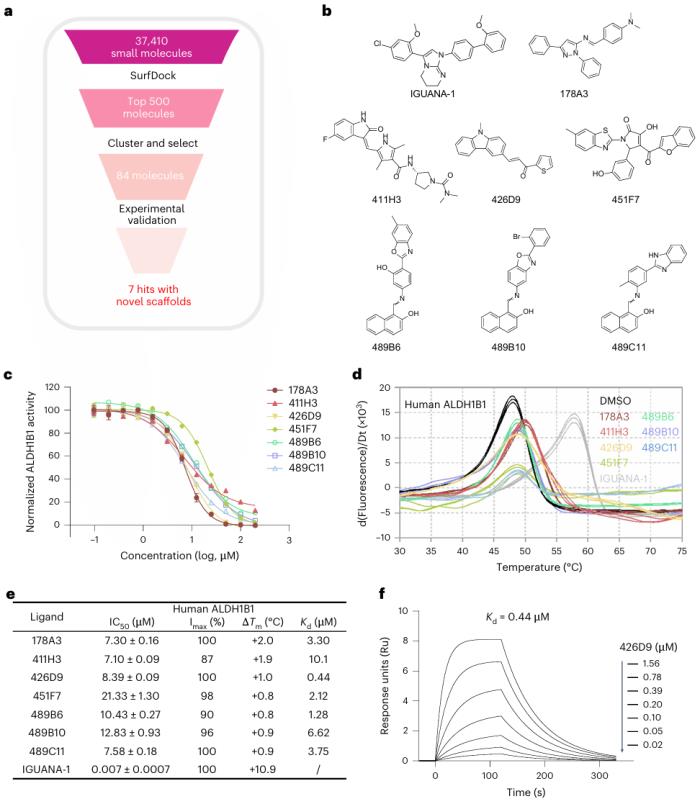
圖示:SurfDock 為 ALDH1B1 確定了新的支架。(來源:論文)
研究中,該團隊還展示了 SurfDock 在現實世界小分子發現項目中的實際用途,該項目針對目標醛脫氫酶 1B1 (ALDH1B1),其中快速識別出具有新骨架的七個命中分子。
局限性
雖然經驗結果表明 SurfDock 具有有效的對接能力,但它也存在一些局限性。例如,如果蛋白質在配體結合后發生顯著的構象變化,SurfDock 可能無法準確預測蛋白質-配體復合物,因為它沒有明確適應蛋白質的靈活性。
此外,SurfDock 包括一個可選步驟,用于基于力場的對接后能量最小化,這表明姿勢準確性和有效性有提高的潛力。
結語
盡管如此,SurfDock 所表現出的可靠性、穩健性、物理合理性和實際適用性,表明它確實有成為結構生物學變革工具的潛力。
準確預測蛋白質-配體復合物的能力可以大大提高科學家對蛋白質生物學的理解,并有助于設計新的治療劑。
鑒于計算能力的進步和對各種化學空間的可訪問性的提高,研究人員設想 SurfDock 將成為 SBDD 社區中必不可少的工具,并通過他們的持續改進為對基礎生物學或藥物發現具有重要意義的新靶標的化學驗證鋪平道路。
論文鏈接:https://www.nature.com/articles/s41592-024-02516-y
相關報道:https://phys.org/news/2024-12-ai-enables-reliable-accurate-protein.html
- 免責聲明
- 本文所包含的觀點僅代表作者個人看法,不代表新火種的觀點。在新火種上獲取的所有信息均不應被視為投資建議。新火種對本文可能提及或鏈接的任何項目不表示認可。 交易和投資涉及高風險,讀者在采取與本文內容相關的任何行動之前,請務必進行充分的盡職調查。最終的決策應該基于您自己的獨立判斷。新火種不對因依賴本文觀點而產生的任何金錢損失負任何責任。





 新火種
2024-12-24
新火種
2024-12-24 






