超10億個核苷酸水平的測量,首個RNA基礎模型解鎖RNA藥物發現
編輯 |KX
近日,生物技術公司 Atomic AI 宣布,創建了第一個利用化學制圖數據的大型語言模型(LLM)。Atomic AI 將尖端機器學習與最先進的結構生物學相結合,以解鎖 RNA 藥物發現。
Atomic AI 的研究人員創建了一個新的平臺組件,利用內部使用定制濕實驗室分析收集的大規模化學作圖數據。科學家們收集了數百萬條 RNA 序列的數據,并進行了超過 10 億個核苷酸水平的測量。通過這些數據的訓練,ATOM-1 對 RNA 有了豐富的了解,然后可以用來優化不同 RNA 模式的特性。
Atomic AI 于 12 月 14 日發表在bioRxiv 上的一篇預印本論文《ATOM-1:基于化學圖譜數據構建的 RNA 結構和功能的基礎模型》(「ATOM-1: A Foundation Model for RNA Structure and Function Built on Chemical Mapping Data」)中,Atomic AI 描述了其專有的 ATOM-1? 平臺組件——一個可以準確預測 RNA 結構和功能的基礎模型,有助于顯著改善 RNA 療法的開發。

Atomic AI 首席科學官 Manjunath Ramarao 博士說:
「ATOM-1 能夠預測 RNA 的結構和功能方面以及 RNA 模式的關鍵特征,包括小分子、mRNA 疫苗、siRNA 和環狀 RNA,以幫助有效設計治療方法。我們的目標是創建一個簡化的藥物發現流程,以推進我們自己的管道,并與合作伙伴合作,幫助驗證他們的 RNA 靶點和工具,最終快速、更有效地為患者提供所需的治療方法。」Atomic AI 創始科學家兼機器學習主管 Stephan Eismann 博士說:
「通過構建基于 RNA 核苷酸修飾和下一代測序的大型數據集,Atomic AI 團隊創建了首個 RNA 基礎模型。我們對我們的模型在 RNA 研究的其他方面的廣泛應用以及它優化基于 RNA 的藥物的各種特性的潛力感到興奮,例如 mRNA 疫苗的穩定性和翻譯效率或 siRNA 的活性和毒性。」缺乏可用的高質量 RNA 數據基于 RNA 的藥物和 RNA 靶向藥物正在成為治療疾病的有前途的新方法。通過簡單的實驗篩選來優化這些療法是一個耗時且昂貴的過程,而合理的設計需要準確理解 RNA 的結構和功能。
迄今為止,生命科學界幾乎沒有可用的高質量 RNA 數據,因為現有的方法,如用于收集體內信息的動物模型或用于確定 3D RNA 結構的冷凍電子顯微鏡(cryo - EM),難以使用且耗時。由于缺乏「真實」數據,優化關鍵 RNA 治療特性(包括穩定性、毒性和翻譯效率)一直具有挑戰性。
首個在化學圖譜數據上訓練的 RNA 基礎模型
為了應對這一設計挑戰,Atomic AI 推出了 ATOM-1,這是第一個在化學圖譜數據上訓練的 RNA 基礎模型,通過專門為機器學習訓練開發的數據收集策略來實現。在 ATOM-1 嵌入之上使用小型探針(probe)神經網絡,證明該模型已經開發了豐富的 RNA 內部表示。經過有限數量額外數據的訓練,這些小型網絡在關鍵 RNA 預測任務上實現了最先進的準確性,這表明這種方法可以實現整個 RNA 領域的療法設計。
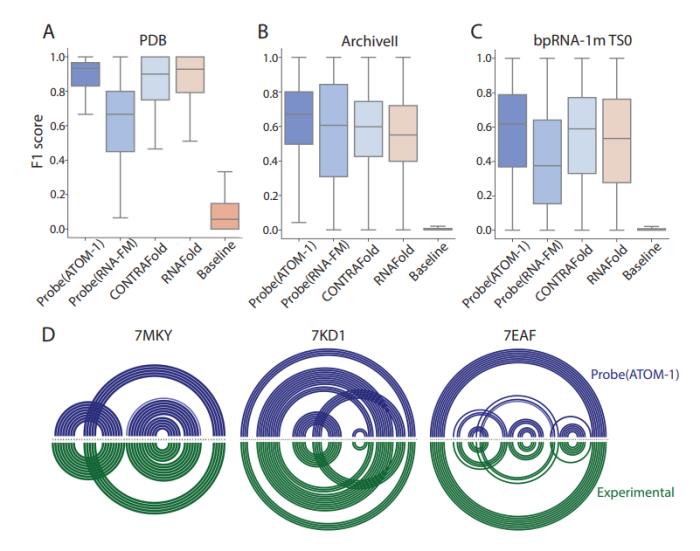
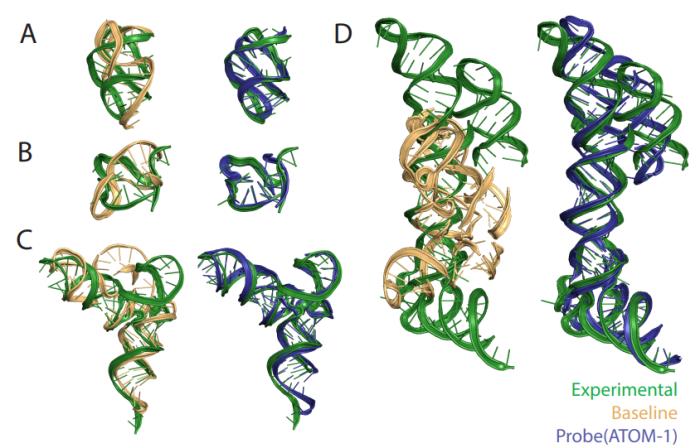
與之前發表的方法相比,ATOM-1 能夠更準確地預測 RNA 二級和三級結構。
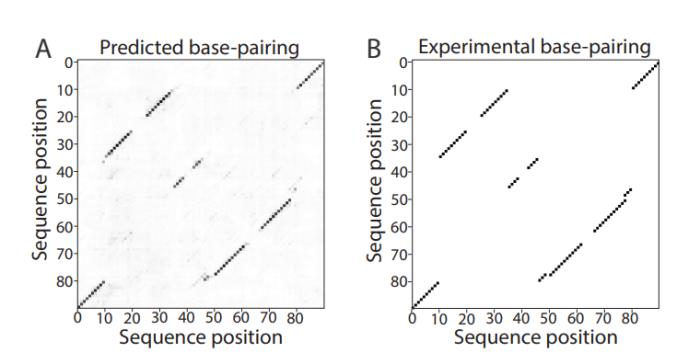
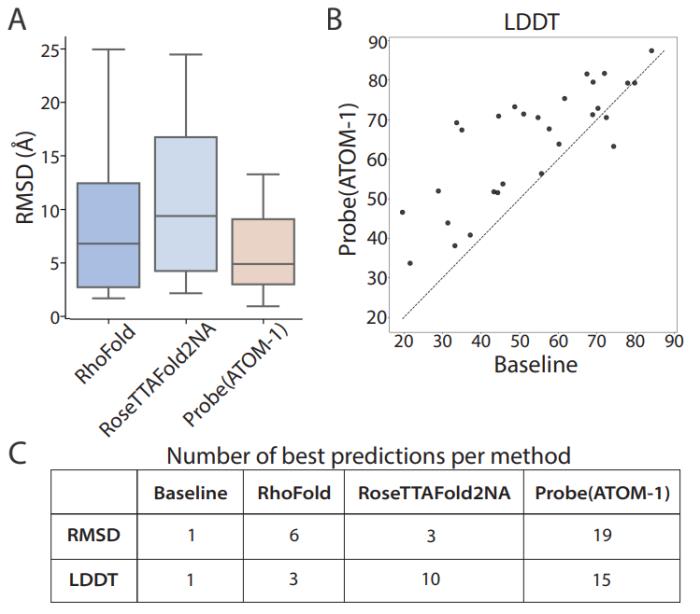
值得注意的是,在比較 ATOM-1 與其他疫苗設計計算工具的回顧性分析中,ATOM-1 優于所有 1,600 種其他預測溶液內 mRNA 穩定性的方法。基于這些結果,新的基礎模型可以用有限的數據進行調整,以預測 RNA 的不同特性,不僅可以確定 RNA 的結構,還可以預測 RNA 療法的其他關鍵特征。
「在過去的兩年半中,我們一直在有目的地設計和收集數據來訓練我們的基礎模型,」Atomic AI 創始人兼首席執行官 Raphael Townshend 博士說。「通過機器學習和生成人工智能,我們現在有了一個獨特的機會,ATOM-1 可以通過少量初始數據點進行調整,以高精度預測 RNA 的結構和功能。」
曾登 Science 封面,Atomic AI 專有的AI 驅動 3D RNA 結構引擎Atomic AI 是一家新興生物技術公司,成立于 2021 年 5 月,總部位于舊金山灣區,專注于利用機器學習和結構生物學的融合來推進 RNA 藥物發現。該公司開發了一個專有平臺,利用深度學習基礎模型來探索和設計 RNA 靶向小分子、基于 RNA 的藥物和 RNA 工具。
Atomic AI 的技術的相關文章《RNA 結構的幾何深度學習》(「Geometric deep learning of RNA structure」)已登上《Science》雜志封面。

Atomic AI 專有的人工智能驅動的 3D RNA 結構引擎(稱為 PARSE)可生成 RNA 結構數據集,將機器學習基礎模型與大規模內部實驗濕實驗室生物學相集成,以揭示 RNA 靶標的功能結合物。
其突破性技術能夠以前所未有的速度和準確性預測結構化、可配體的 RNA 基序,這是當前 RNA 藥物發現方法的一個關鍵障礙。
通過將這些算法進步與大規模實驗生物學相結合,能夠設計新型 RNA 靶向藥物和基于 RNA 的藥物來治療目前無法成藥的疾病。
利用其發現和設計的 3D RNA 結構數據庫,Atomic AI 計劃開發一系列合理設計的小分子候選藥物。
Atomic AI 在兩輪投資中籌集了總計 4200 萬美元的資金,最新一輪融資于 2023 年 1 月獲得 A 輪融資。
在由機器學習研究人員、藥物化學家、工程師和實驗生物學家以及戰略科學顧問和世界級投資者組成的跨學科團隊的支持下,Atomic AI 在人工智能增強的結構生物學領域處于領先地位,并改變了 RNA 藥物的設計,以治療無法治療的疾病。
- 免責聲明
- 本文所包含的觀點僅代表作者個人看法,不代表新火種的觀點。在新火種上獲取的所有信息均不應被視為投資建議。新火種對本文可能提及或鏈接的任何項目不表示認可。 交易和投資涉及高風險,讀者在采取與本文內容相關的任何行動之前,請務必進行充分的盡職調查。最終的決策應該基于您自己的獨立判斷。新火種不對因依賴本文觀點而產生的任何金錢損失負任何責任。





 新火種
2024-01-03
新火種
2024-01-03 






